Т.А.Байкова, Т.Н.Лопаткина Клиника нефрологии, внутренних и профессиональных болезней им. Е.М. Тареева, Первый МГМУ им. И.М.Сеченова, МГУ им. М.В. Ломоносова
Изучение хронических вирусных поражений печени выявило широкий спектр внепеченочных проявлений хронического гепатита В (ХГВ), а впоследствии, при открытии вируса гепатита С, и хронического гепатита С (ХГС). В России ведущая роль в изучении системности поражения при вирусных заболеваниях печени принадлежит исследованиям, проведенным в клинике им. Е.М.Тареева: изучение хронического активного гепатита как системного заболевания (Апросина З.Г., 1974, 1981 гг.), внепеченочных поражений при ХГС (Игнатова Т.М., 2000 г., Русских А.В., 2004 г., Милованова С.Ю., 2005 г., Карпов С.Ю., 2005 г.); при ХГВ (Ильянкова А.А., 2001 г., Абдурахманов Д.Т., 2003 г., Ибрагимова М.М., 2004 г., Крель П.Е., 1995 г., Тэгай С.В., 2003 г., Русских А.В., 2004 г.), поражения системы крови (Гусейнова Л.А., 1981 г.), легких (Дроздова А.С., 1989 г.), почек (Потапова А.В., 1989 г., Косминкова Е.Н., 1992 г.), синдрома Шегрена (Лопаткина Т.Н., 1980 г., Чернецова О.В., 2004 г.), системных васкулитов при вирусных гепатитах (Семенкова Е.Н., 1994).
В развитии внепеченочных поражений основное значение имеют иммунные реакции, возникающие в ответ на репликацию вирусов гепатита В или С в печени, в тканях лимфоидного и нелимфоидного происхождения. Предположения о наличии внепеченочных сайтов репликации вирусов гепатита В и С возникли в связи с наблюдением случаев быстро развивающегося острого гепатита у пациентов с вирусным циррозом печени после пересадки здоровой донорской печени. Инфицирование донорского органа у больных после ортотопической трансплантации печени объяснялось внепеченочной локализацией вирусов [1]. Помимо иммунных нарушений в возникновении системных поражений имеет значение прямое цитопатическое действие вирусов гепатита. Нередко внепеченочные поражения (ВПП) являются единственным проявлением вирусной инфекции и могут определять прогноз и тактику лечения заболевания.
Особенности хронического гепатита В с внепеченочными проявления гепатита.
Внепеченочные проявления гепатита встречаются у 10-20% больных хроническим гепатитом В и включают широкий спектр поражений различных органов и систем [2]. Поражения кожи, наблюдаемые при острых и хронических болезнях печени, обусловленных HBV, весьма вариабельны и включают макулярные, макулопапулярные, папуловезикулярные высыпания, рецидивирующую крапивницу, петехии, пурпуру, узловатую эритему, скарлатиноподобную сыпь, гангренозную пиодермию, витилиго, гиперпигментацию и изъязвления в области нижних конечностей, аллергический капиллярит, пурпуру Шенлейна-Геноха [3-7].
Смешанная криоглобулинемия (СКГ) встречается среди больных ХГВ в 3-17% случаев, может проявляться кожной пурпурой, артритами и/или артралгиями, поражением почек, синдромом Рейно [5, 6, 8, 9]. Поражение почек при ХГВ протекает в трех формах – хронический гломерулонефрит (ХГН), тубулоинтерстициальный нефрит (ТИН), в рамках васкулита при узелковом полиартериите, ассоциированном с HBVинфекцией [10-16]. Частота поражения почек при ХГВ составляет 14%, в том числе ХГН – 12,6%, ТИН – 1,4% [11]. В клубочках выявляются депозиты различных антигенов HBV, включая HBsAg, HBeAg, HBcAg; у части больных в ткани почки была обнаружена HBV ДНК [13]. ИК могут активировать комплемент и вызывать поражение клубочков путем формирования мембраноатакующих комплексов и дальнейшего каскада реакций, таких как индукция протеаз, оксидативное повреждение и разрушение цитоскелета нефрона [14]. Узелковый полиартериит (УП) является системным васкулитом с поражением средних и мелких артерий. Циркулирующие ИК, содержащие вирусные белки, вовлекаются в патогенез УП, ассоциированного с HBV инфекцией [15]. По данным Е.Н. Семенковой, инфицирование вирусом гепатита В выявляется в 56,9% случаев УП. [16] Отмечено, что почти все случаи HBV-ассоциированного УП связаны с инфекцией вируса гепатита В дикого типа, характеризующейся HBe-антигенемией и высокой репликацией HBV. Предположительно повреждение почек происходят в результате отложения вирусных HBeAg-HBeAb ИК [15]. В целом, хроническая HBV-инфекция демонстрирует широкий спектр внепеченочных поражений, в генезе которых имеют значение как иммунокомплексные реакции, так и реакции гиперчувствительности замедленного типа.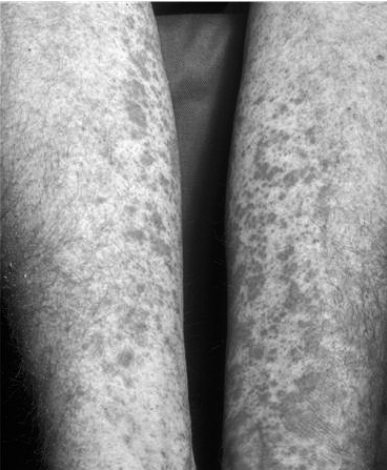
Рис.1. Пурпура на коже нижних конечностей у больного хроническим гепатитом С
Внепеченочные проявления гепатита В могут длительно маскировать поражение печени, являясь ведущими клиническими проявления гепатита болезни и нередко определяющими прогноз заболевания. Однако, с введением программ массовой вакцинации против вируса гепатита В инфицированность населения начала снижаться. А после открытия в 1989 году вируса гепатита С все большее значение стало придаваться изучению обширного спектра поражений при этой инфекции. Особенности хронического гепатита С с внепеченочными проявления гепатита. Согласно различным исследованиям, от 40 до 74% пациентов, инфицированных вирусом гепатита С, могут иметь хотя бы одно внепеченочное проявление (ВПП) за время течения болезни [17, 18, 19]. Более того, ВПП могут являться первым признаком HCV инфекции в отсутствии у ряда больных признаков поражения печени. Основной особенностью ХГС является частое развитие внепеченочных поражений преимущественно иммунокомплексного генеза, в первую очередь обусловленных смешанной криоглобулинемией (СКГ), выявляемой у 19-56% больных [18, 20, 21]. Только небольшая группа больных ХГС с СКГ (менее 15%) имеет симптомное течение – криоглобулинемический синдром [21, 22]. Распространенность смешанной криоглобулинемии увеличивается с длительностью HCV-инфекции в организме и продолжительностью заболевания и чаще наблюдается у женщин на 2-м-3-м десятилетии болезни. В некоторых исследованиях показано, что длительность HCV инфекции у больных ХГС со СКГ почти в 2 раза выше, чем у пациентов без СКГ, у 40% больных со СКГ выявляют признаки цирроза печени [20]. В настоящее время установлено, что вирус гепатита С имеет высокий тропизм к мононуклеарам периферической крови, которые могут служить его резервуаром и местом репликации. Вирус гепатита С связывается с лигандом CD81 на поверхности В-лимфоцитов через Е2-белок, что приводит к активации этих лимфоцитов. На первом этапе продуцируются только поликлональные криоглобулины, затем доминирующий клон В-клеток начинает продуцировать моноклональные иммуноглобулины. Смешанная криоглобулинемия является причиной системного васкулита с поражением сосудов мелкого и среднего калибра с возможным вовлечением в патологический процесс различных органов и систем [18, 23, 24]. Известно, что при ХГС васкулиты могут быть обусловлены не только СКГ, но и (со значительно меньшей частотой) – иммунными комплексами, не обладающими свойствами преципитировать на холоде, то есть не содержащими IgM РФ [18, 25, 26]. Поражение кожи чаще всего (95% случаев) представлено кожным васкулитом от пурпуры (лейкоцитокластический васкулит) и петехий на нижних конечностях (рис. 1) до выраженных некротических язв. Биопсия кожи в местах повреждений выявляет иммунокомплексный васкулит мелких сосудов с мононуклеарной инфильтрацией. HCV-антитела выявляются в кожных повреждениях в 40% случаев [19]. Пурпура у больных ХГС без СКГ характеризуется меньшей распространенностью и отсутствием язвенно-некротических изменений кожи по сравнению с больным со СКГ [27]. Синдром Рейно при ХГС часто является ранним клиническим проявлением КГ-синдрома, как правило, протекает без дигитальных некрозов. Однако, при высоком криокрите частота дигитальных некрозов увеличивается [10, 27]. Поражение мышц. Миалгии часто наблюдаются при ХГС, особенно в рамках КГ-синдрома в сочетании с артралгиями, кожным васкулитом. Имеются сообщения сочетающегося с ХГС полимиозита, дерматомиозита [10, 18, 28]. Почки при HCV-ассоциированной СКГ вовлекаются в 35-60% случаев. Наиболее часто встречающийся тип гломерулонефрита – мезангиокапиллярный гломерулонефрит (МКГН). HCV РНК выявляется в сыворотке у 81% больных МКГН с СКГ против 25% случаев некриоглобулинемического МКГН. В почечной паренхиме экспрессируются рецепторы CD81 и SR-B1, позволяющие связаться вирусу гепатита С с поверхностью клетки и проникать внутрь посредством эндоцитоза [29]. Поражение почек встречается в дебюте заболевания у 20% больных ХГС с криоглобулинемией. Среди больных ХГС с поражением почек в 25% случаев развивается протеинурия нефротического уровня (>3 г/сут), отеки, гипертензия и гипокомплементемия. В 30% случаев вовлечение почек начинается с остронефритического синдрома и ОПН (олигурическая в 5% случаев). В 55% случаев отмечается только легкая гематурия, протеинурия и начальные стадии почечной недостаточности. При биопсии почки выявляются иммунокомплексные депозиты IgG, IgM с активностью ревматоидного фактора (РФ) и С3 в капиллярной сети. Наиболее характерной гистологической картиной при световой микроскопии являются капиллярные тромбы, состоящие из преципитированных криоглобулинов. Реже HCV вызывает фокальный сегментарный гломерулярный склероз, мембранозный или пролиферативный гломерулонефрит [30]. Картина HCV-ассоциированного некриоглобулинемического МКГН не имеет существенных отличий по клиническим и морфологическим признакам от таковой при идиопатическом МКГН [31]. Клиническое течение болезни в 30% случаев медленное и функция почек остается сохранной многие годы. В 20% случаев болезнь характеризуется рецидивирующими эпизодами остронефритического синдрома. Менее чем в 15% случаев больным требуется диализ в связи с терминальной уремией [19, 30]. Нейропатия, связанная с СКГ отмечается у 7-90% больных ХГС, является в основном сенсорной и характеризуется онемением, жжением, покалыванием, ползаньем “мурашек”, зудом, чаще всего на руках и ногах, но могут проявляться на других участках тела. Неврологические поражения также были описаны у больных ХГС без СКГ. В основном, это мононейропатия, а также поражение периферической нервной системы, ассоциированное с узелковым полиартериитом, которое обычно представлено асимметричной полинейропатией с ведущими моторными нарушениями [19, 27]. Поражение легких. Описано вовлечение сосудов легких (легочный васкулит) в рамках СКГ, проявляющееся легочными инфильтратами, альвеолярными кровотечениями [18]. Имеется ряд наблюдений фиброзирующего альвеолита у больных ХГС, в том числе с морфологическим подтверждением и обнаружением HCV РНК в ткани легкого [28]. В некоторых регионах мира (Италия, Япония) частота выявления HCV инфекции среди больных фиброзирующим альвеолитом составила 13-14%, что значительно превысило частоту в соответствующих популяциях [32]. Эти данные, а также результаты исследований бронхоальвеолярной жидкости у больных ХГС, выявляющих повышенное содержание лимфоцитов и эозинофилов, позволили обсуждать триггерную роль HCV в развитии альвеолита [18]. В то же время в Англии частота HCV-инфекции у больных фиброзирующим альвеолитом оказалась невысокой (1,6%) и роль HCV в его патогенезе ставится под сомнение [33].
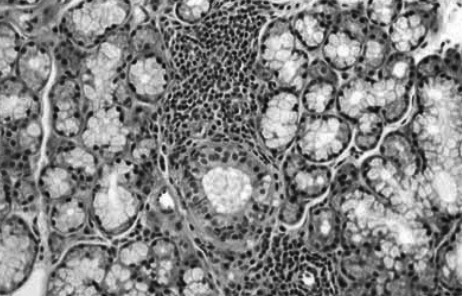 Рис. 2. Очаговая лимфоцитарная инфильтрация слюнной железы, характерная для синдрома Шегрена
Рис. 2. Очаговая лимфоцитарная инфильтрация слюнной железы, характерная для синдрома Шегрена
По данным клиники им. Е.М.Тареева частота поражения легких была выше у больных без СКГ (11,3%), чем с КГ (6,3%). В группе пациентов без КГ поражение легких характеризовалось развитием фиброзирующего альвеолита, у больных с КГ наблюдалась картина легочного васкулита [27]. Поражение сердца. Имеются наблюдения миокардита хронического течения на фоне HCV-инфекции. Поражение миокарда, ассоциированное с HCV-инфекцией, может быть обусловлено: прямым (вирусным) воздействием на миокард; непрямым (иммунологическим) механизмом поражения и апоптозом клеток, обусловленным внутренними и внешними сигналами [34]. Имеются данные о прямом повреждающем действии на миокард core-белка вируса. Иммуноопосредованный путь повреждения миокарда осуществляется при участии В-клеток, Т-клеток и макрофагов. Обнаружение (+) и (-)-цепей HCV РНК в ткани миокарда у больных миокардитом, дилатационной миокардиопатией и (+)-цепи HCV РНК в миокарде больных гипертрофической кардиомиопатией, сочетающихся с HCV-инфекцией, позволяют обсуждать возможность репликации HCV в ткани миокарда. Обсуждается также роль реакций клеточного иммунитета на тканевые антигены вируса и индуцированные им аутоантигены, роль иммунных комплексов в патогенезе поражения миокарда. Кроме того, не исключается роль цитокинов (продуцируемых активированными вирусом иммуноцитами), которые через механизм повышения продукции оксида азота вызывают отрицательный инотропизм и повреждение сердечной мышцы [35].
Поражение суставов. Артралгии и/или артриты встречаются у 21-74% больных ХГС [19, 24]. Артриты при хронической HCV-инфекции могут рассматриваться как часть аутоиммунного процесса (например, в связи с криоглобулинемией) или как независимый процесс. Описано два вида поражения суставов: полиартрит мелких суставов, подобный ревматоидному артриту, который встречается очень редко и имеет мягкое течение; и неэрозивный олигоартрит с вовлечением средних и крупных суставов, часто интермиттирующего течения, как правило, связанный с криоглобулинемией. Ревматоидный фактор в сыворотке крови выявляется в 50-80% случаев. Антитела к циклическому цитруллиновому пептиду (АЦЦП) обнаруживаются менее, чем у 6% больных с HCV-ассоциированным артритом, что можно использовать для дифференциального диагноза ревматоидного артрита и поражения суставов в рамках HCV-инфекции [19]. Синдром Шегрена (СШ). У больных ХГС с высокой частотой (14-77%) выявляются морфологические признаки лимфоцитарного сиалоаденита и поражение слезных желез (у 26-50%).
Морфологические изменения малых слюнных желез характеризовались небольшой воспалительной инфильтрацией (рис. 2) и распространенным фиброзом ацинарной ткани [36, 37]. Клинически ксерофтальмия и ксеростомия имеют субклиническое течение у 73,8% больных, клинически очевидный СШ отмечается у больных ХГС с КГ [37]. Синдром Шегрена у больных является фактором риска развития злокачественной В-клеточной лимфомы, особенно при сочетании со СКГ [38]. Поражение щитовидной железы. Прямая связь между HCV-инфекцией и заболеванием щитовидной железы до конца не установлена, однако, поражение щитовидной железы (особенно гипотиреоз) чаще встречается среди больных ХГС, чем в общей популяции. У 13% больных, инфицированных HCV, выявляется гипотиреоз и у 25% обнаруживаются антитиреоидные антитела. В 30% случаев поражение щитовидной железы выявляется в ходе ПВТ. В связи с этим остается открытым вопрос, является ли нарушение функции щитовидной железы вирус-индуцированным или нежелательным эффектом противовирусной терапии. ПВТ, возможно, вызывает развитие нарушения функции щитовидной железы de novo или вызывает обострение уже существующего субклинического поражения щитовидной железы [39, 40].
HCV-инфекция и неходжкинская В-клеточная лимфома. В настоящее время доказана этиологическая роль HCV в развитии КГ II типа, представляющей собой доброкачественное лимфопролиферативное заболевание (ЛПЗ), в основе которого лежит клональная (IgMk) пролиферация В-лимфоцитов. Установлено, что у части больных ХГС доброкачественная лимфопролиферация трансформируется в злокачественную. 8-10% больных, имеющих СКГ II типа, формируют В-клеточную лимфому. Показана высокая частота HCV-инфекции и при моноклональной иммуноглобулинопатии, обусловленной пролиферацией других (не продуцирующих СКГ) клонов лимфоцитов, а также значительная (до 11%) частота обнаружения моноклональной иммуноглобулинопатии среди больных ХГС. Вирус гепатита С персистирует в иммунокомпетентных клетках кроветворной системы, но не способен к интеграции в геном клетки хозяина. Процесс лимфомогенеза (как и гепатоканцерогенеза) при HCV-инфекции рассматривается как длительный многостадийный процесс, в основе которого лежит патологическая пролиферация клеток, сочетающаяся с повреждением их генома. Патологическая пролиферация связывается со снижением порога активации В-лимфоцитов, обусловленной взаимодействием HCV со специфическими рецепторами В-клеток (CD81), а также подавлением апоптоза. В В-лимфоцитах при HCV-инфекции повышается экспрессия bcl-2 белка (вследствие t(14;18) транслокации), играющего важную роль в подавлении апоптоза. Показано также, что core-протеин HCV регулирует с-myc транскрипцию и что bcl-2 и c-myc взаимодействуют в лимфомогенезе. Гистологически наиболее распространены фолликулярная лимфома, В-клеточная хроническая лимфоцитарная лейкемия/лимфома из малых лимфоцитов, лимфоплазмоцитарная лимфома и лимфома маргинальной зоны. Среди последних была описана особая ассоциация HCV-инфекции с MALT-лимфомой [18, 41, 42] Таким образом, при хроническом гепатите С многообразие внепеченочных проявлений инфекции обусловлено, в первую очередь, смешанной криоглобулинемией и характеризуется развитием у ряда больных криоглобулинемического синдрома с поражением кожи, суставов, мышц, почек и других органов и систем. Особенностью доброкачественной лимфопролиферации, свойственной ХГС, является возможность трансформации в злокачественную с развитием В-клеточной лимфомы.
Как и при ХГВ, внепеченочные проявления гепатита ХГС создают определенные трудности в дифференциальном диагнозе ХГС, определяя у части больных неблагоприятный прогноз криоглобулинемического васкулита, поражения почек, В-клеточной лимфомы. Особенности лечения хронических гепатитов В и С с системными проявления гепатита. Адекватный подход к лечению хронических вирусных гепатитов с внепеченочными проявлениями гепатита включает в себя две независимые, но тесно связанные цели. Первая – эрадикация вируса или снижение вирусной нагрузки с помощью этиотропной противовирусной терапии. Вторая – патогенетическое лечение аутоиммунных нарушений с использованием иммуносупрессивной терапии и/или плазмафереза с целью контроля образования иммунных комплексов. По мнению большинства исследователей, для лечения хронической HBV-инфекции оптимальна комбинированная терапия: использование препаратов, различающихся по механизму действия, – сочетание ИФН-? с аналогами нуклеоз(т)идов, сочетание нескольких аналогов нуклеоз(т)идов. Преимуществом интерферона-? является более низкая частота рецидивов после отмены препарата, а аналогов нуклеоз(т)идов – отсутствие нежелательных эффектов, в том числе иммуностимулирующего действия, что обусловливает его применение у больных с внепеченочными проявлениями гепатита и декомпенсированным циррозом печени. В ряде случаев при наличии миокардита, тубулоинтерстициального нефрита, полимиозита оправдано применение иммуносупрессивной терапии, несмотря на усиление репликации вируса гепатита В под влиянием стероидов [6,43-46]. Лечение ХГС со СКГ направлено на подавление вирусной репликации и угнетение В-клеточной пролиферации. Эрадикация HCV при противовирусной терапии приводит к исчезновению СКГ и регрессу клинических проявлений, но часть больных ХГС не отвечает на ПВТ, у ряда пациентов отмечаются выраженные нежелательные эффекты лечения. Применение кортикостероидов при хроническом вирусном гепатите с аутоиммунными нарушениями может приводить к увеличению вирусной нагрузки. В то же время, известно, что интерферонотерапия может вызывать ухудшение таких внепеченочных проявлений HCV-инфекции, как периферическая нейропатия, миокардит, тубуло-интерстициальный нефрит, полимиозит. Недавно было предложено использовать ритуксимаб (химерные моноклональные антитела к CD20) в качестве анти-В-клеточной терапии у больных ХГС с криоглобулинемией, не отвечающих на ПВТ [47, 48]. Его действие связано с быстрым, но обратимым, угнетением CD20+ В-клеток в периферической крови [49, 50]. Ряд исследований свидетельствуют об эффекте ритуксимаба у больных ХГС с периферической нейропатией и комбинации ритуксимаба и плазмафереза у больных ХГС с криоглобулинемическим васкулитом [47, 51], а также эффективность ритуксимаба и ПВТ у больных ХГС с КГ-гломерулонефритом и сосудистой пурпурой [23, 52]. Таким образом, лечение больных хроническими вирусными гепатитами с внепеченочными проявления гепатита не разработано, представляет серьезные проблемы и нуждается в дальнейшем изучении и выработке тактики.
Литература
Крель П.Е., Цинзерлинг О.Д. Внепеченочная локализация вируса гепатита С: особенности клинических проявлений и прогностическая значимость. Тер. архив 2009; 11: 63-68. Cacoub P, Terrier B. Hepatitis B-related autoimmune manifestations. Rheum Dis Clin North Am. 2009; 35(1): 125-37. Апросина З.Г. Хронический активный гепатит как системное заболевание. М: Медицина; 1981. Серов В.В., Апросина З.Г., Крель П.Е. Клинико-морфологическая характеристика внепеченочной патологии, обусловленной вирусом гепатита В. Арх. патологии 1989; 51(12): 3-9. Абдурахманов Д.Т., Русских А.В. Внепеченочные проявления гепатита хронической HBV-инфекции. – Клин. фармакология 2003; 12(1): 18-22. Абдурахманов Д.Т. Хронический гепатит В и D. М: ГЭОТАР-Медиа; 2010. Русских А.В., Козловская Л.В., Кривошеев О.Г., Мухин Н.А. Сосудистая пурпура при хронических диффузных заболеваниях печени. Клин. медицина 2005; 83(10):45-48. Garcia de La Pena Lefebvre P., Mouthon L., Cohen P., Lhote F., Guillevin L. Polyarteritis nodosa and mixed cryoglobulinaemia related to hepatitis B and C virus coinfection. Ann. Rheum. Dis. 2001; 60(11):1068-9. Апросина З.Г., Попов М.С., Гусейнова Л.А. и др. Синдром Рейно с гангреной концевых фаланг кистей и миокардит при вирусном (HBsAgположительном циррозе печени (клинико-морфологическое наблюдение). Тер. архив 1987; 2: 136-139. 0. Серов В.В., Апросина З.Г. Хронический вирусный гепатит. М: Клиническая гепаМедицина, 2004. 11. Косминкова Е.Н., Козловская Л.В. Особенности поражения почек при хронических диффузных заболеваниях печени, обусловленных вирусом гепатита В. Тер. архив 1992; 6: 43-46. 12. Chan T.M. Hepatitis B and renal disease. Curr. Hepatitis Rep. 2010; 9: 99105. 13. Chen L., Wu C., Fan X. et al. Replication and infectivity of hepatitis B virus in HBV-related glomerulonephritis. Int. J. Infect. Dis. 2009; 13:394-398. 14. Nangaku M., Couser M.G. Mechanisms of immune-deposit formation and the meditaion of immune renal injury. Clin. Exp. Nephrol, 2005; 9: 183-191. 15. Janssen H.L., van Zonneveld M., van Nunen A.B., Niesters H.G., Schalm S.W., de Man R.A. Polyarteritis nodosa associated with hepatitis B virus infection. The role of antiviral treatment and mutations in the hepatitis B virus genome. Eur. J. Gastroenterol. Hepatol. 2004; 16(8): 801-7. 16. Семенкова Е.Н., Апросина З.Г., Лопаткина Т.Н. Узелковый периартериит и инфицирование вирусом гепатита В. Тер. архив 1992; 64(11): 116-121. 17. Cacuob P., Poynard T., Ghillani P. et al. Extrahepatic manifestations of chronic hepatitis C. MULTIVIRC group. Multidepartment Virus C. Arthritis Rheum. 1999; 42: 2204-2212. 18. Игнатова Т.М., Апросина З.Г., Серов В.В. и др. Внепеченочные проявления гепатита хронической HCV-инфекции. Рос. мед. журнал 2001; 2: 1318. 19. Galossi A., Guarisco R., Bellis L., Puoti C. Extrahepatic manifestations of chronic HCV infection. J. Gastrointestin. Liver Dis. 2007; 16(1): 65-73. 20. Lunel M., Musset L., Cacoub P. et al. Cryoglobulinemia in chronic liver diseases: role of hepatitis C virus and liver damage. Gastroenterology 1994; 106: 1291-1300. 21. Kayali Z., Buckwold V.E., Zimmerman B., Schmidt W.N. Hepatitis C, cryoglobulinemia and cirrhosis: a meta-analysis. Hepatology 2002; 36: 978-985. 22. Webster D.P., Klenerman P., Collier J., Jeffrey K.J. Development of novel treatments for hepatitis C. Lancet Infect. Dis. 2009; 9: 108-117. 23. Милованова С., Русских А., Козловская Л., Игнатова Т. Геморрагический кожный васкулит у больных хроническим гепатитом С с криоглобулинемией. Врач 2011; 4: 101-104. 24. Милованова С. Особенности внепеченочных проявлений хронического гепатита С при криоглобулинемии. Врач 2005; 5: 27-29. 25. Adinolfi L.E., Utili R., Attanasio V. et al. Epidemiology, clinical spectrum and prognostic value of mixed cryoglobulinemia in hepatitis C virus patients: a prospective study. Ital. J. Gastroenterol. 1996; 9: 1-9. 26. D’Amico G. Renal involvement in hepatitis C infection: cryoglobulinemic glomerulonephritis. Kidney Intern. 1998; 54: 650-671. 27. Милованова С.Ю., Игнатова Т.М., Некрасова Т.П. и др. Особенности течения хронического гепатита С с криоглобулинемией. Рос. журнал гастроэнтерологии, гепатологии, колопроктологии 2005; 5: 47-52. 28. Weidensaul D., Imam T., Holyst M.-M. et al. Polymyositis, pulmonary fibrosis and hepatitis C. Arthr. Rheumat. 1995; 38: 437-439. 29. Perico N., Cattaneo D., Bikbov B., Remuzzi G. Hepatitis C infection and chronic renal diseases. Clin. J. Am. Soc. Nephrol. 2009; 4: 207-220. 30. Козловская Л.В., Гордовская Н.Б., Малышко Е.Ю., и др. Криоглобулинемическое поражение почек – особенности течения и лечение. Нефрология и диализ 2002; 4(1): 4-8. 31. Милованова С., Тэгай С., Коротчаева Ю., Козловская Л. Поражение почек, ассоциированное с инфицированием вирусами гепатита В и С. Врач 2007; 6: 70-74. 32. Meliconi R., Andreoni P., Fasano L. et al. Incidence of hepatitis C virus infection in Italian patients with idiopathic pulmonary fibrosis. Thorax 1996; 51: 315-317. 33. Irving W.L., Day S., Johnson I.D.A. Idiopathic pulmonary fibrosis and hepatitis C virus infection. Am. Rev. Respir. Dis. 1993; 148: 1683-1684. 34. Sanchez M.J., Bergasa N.V. Hepatitis C associated cardimyopathy: Potential pathogenic mechanisms and clinical implications. Med. Sci. Monit. 2008; 14(5): 55-63. 35. Matsumori A. Hepatitis C virus and cardiomyopathy. Herz 2000; 25:249254. 36. Pirisi M., Scott C., Fabris C. et al. Mild sialoadenitis: a common findings in patients with hepatitis C virus infection. Scand. J. Gastroenterol. 1994; 29: 940-942. 37. Чернецова О.В., Лопаткина Т.Н, Попова И.В. и др. Синдром Шегрена при хроническом гепатите С: клинические особенности и диагностика. Тер.архив 2003; 4: 33-37. 38. Conca P., Tarantino G. Hepatitis C virus lymphotropism and peculiar immunological phenotype: Effects on natural history and antiviral therapy. World J. Gastroenterol. 2009; 15(19): 2305-2308. 39. Галян Е.В., Кравец Е.Б., Латыпова В.Н., Дамдиндорж Д. Струкутрнофункиональные особенности щитовидной железы у пациентов с хроническими гепатитами В и С. Бюллетень сибирской медицины 2009; 2: 96-100. 40. Vezali E, Elefsiniotis I, Mihas C, Konstantinou E, Saroglou G. Thyroid dysfunction in patients with chronic hepatitis C: virus- or therapy-related? J Gastroenterol Hepatol. 2009; 24(6):1024-9. 41. Zignego A.L., Giannini C., Ferri C. Hepatitis C virus-related lymphoproliferative disorders: An overview. World J. Gastroenterol. 2007; 13(17): 24672478. 42. Luppi M., Longo G., Ferrari M.G. et al. Additional neoplasms and HCV infection in low-grade lymphoma MALT type. Br. J. Haematol. 1996; 94: 373-375. 43. Guillevin L, Mahr A, Cohen P, et al. Short-term corticosteroids then lamivudine and plasma exchanges to treat hepatitis B virusrelated polyarteritis nodosa. Arthritis Rheum. 2004, 51: 482-487. 44. Sawabe T., Uenotsuchi T., Imafuku S., Kohno H., Arima J. Remission of hepatitis B virus-related vasculitis with lamivudine. Ann. Intern. Med. 2004, 140:672-673. 45. Cakir N, Pamuk ON, Umit H, Midilli K. Successful Treatment with Adefovir of One Patient Whose Cryoglobulinemic Vasculitis Relapsed under Lamivudine Therapy and Who was Diagnosed to Have HBV Virologic Breakthrough with YMDD Mutations. Intern Med. 2006; 45(21): 12131215. 46. Zhang Y., Zhou J.-H., Yin X.-L., Wang F.-Y. Treatment of hepatitis B virusassociated glomerulonephritis: a meta-analysis. World J. Gastroenterol. 2010; 16(6): 770-777. 47. Tallarita T., Gagliano M., Corona D., Giuffrida G., Giaquinta A., Zerbo D., Sorbello M., Veroux P., Veroux M. Successful combination of Rituximab and plasma exchange in the treatment of cryoglobulinemic vasculitis with skin ulcers: a case report. Cases Journal 2009; 2: 7859. 48. Meurs E.F., Breiman A. The interferon inducing pathways and the hepatitis C virus. World J. Gastroenterol. 2007; 13: 2446-2454. 49. Leandro M.J., Cambridge G., Ehrenstein M.R., Edwards J.C. Reconstitution of peripheral blood B cells after depletion with rituximab in patients with rheumatoid arthritis. Arthritis Rheum. 2006; 54: 613-620. 50. Uppal R., Charles E., Lake-Bakaar G. Acute wrist and foot drop associated with hepatitis C virus related mixed cryoglobulinemia: Rapid response to treatment with rituximab. J. Clin. Virol. 2010; 47: 69-71. 51. Cavallo R., Roccatello D., Menegatti E., Naretto C., Napoli F., Baldovino S. Rituximab in cryoglobulinemic peripheral neuropathy. J. Neurol. 2009; 256: 1076-1082


